Литий, подарок Земли современному человеку. Почему из всех элементов литий в наши дни стал стратегическим сырьем?
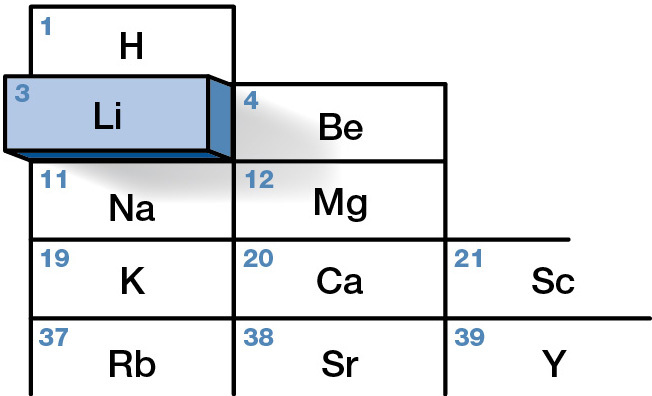
Литий — химический элемент с атомной массой 6,941 (г/моль), относящийся к ряду щелочных металлов. Его получают электролизом солей, таких как хлорид лития.
Применяемый в нескольких промышленных сегментах в качестве реагента и катализатора, используемого при производстве полимеров, литий из-за его низкой плотности и того, что он является хорошим проводником и накопителем энергии, широко используется для производства аккумуляторов.

- Атомный номер: 3,
- Электроотрицательность: 0,98,
- Плотность: 535 кг/м3,
- Химический ряд: Группа 1 (Семейство 1А), ряд щелочных металлов,
- Температура плавления: 1341,85 °С.
Литий начал использоваться в промышленности в 1920-х годах
В 1800 году Хосе Бонифасио де Андрада-и-Силва открыл минерал петалит, также известный как касторит. Этот минерал имеет в своем составе фрагменты лития, который был открыт и идентифицирован как новый химический элемент в 1817 году Йоханом Августом Арфведсоном и Йонсом Якобом Берцелиусом при анализе петалита.
Название литий происходит от греческого и означает «что-то твердое». В 1821 году Уильяму Томасу Бранде удалось выделить литий с помощью электролиза.
Производство лития для промышленного использования началось в 1923 году компанией Metallgesellschaft AG во Франкфурте, Германия. Литий был получен электролизом солей хлорида лития и хлорида калия.
Литий — уникальный материал для изготовления аккумуляторов, сочетающий в себе всевозможные полезные свойства
Литий наверняка возьмет пальму первенства по числу рекордов среди всех других химических элементов. Во-первых, он самый легкий. Это единственный металл, который не тонет в воде и даже в керосине. Самолет, сделанный из лития, смогли бы легко поднять два человека!
Однако ни самолет, ни обшивку морского корабля невозможно сделать из лития по той простой причине, что он энергично взаимодействует с воздухом, водой, многими химическими элементами.
Хранить его — целая проблема. Этот металл нельзя, как натрий, упрятать в керосин или бензин, приходится готовить специальные вазелиновые ванны и вдавливать в них литиевые прутки.
Однако долгое время литий использовался лишь в небольшом количестве медицинских препаратов и в пиротехнике.
Высокая химическая активность лития очень понравилась металлургам. Оказывается, даже ничтожные добавки этого металла (до 0,005 процента) в сталь снижают содержание в ней кислорода, азота, водорода, серы и тем самым делают сталь более плотной, прочной и устойчивой к коррозии.
Долгое время считалась неразрешимой проблема смазки трущихся механизмов в условиях арктической стужи. Любой самый мощный вездеход оказался бы мертвой грудой металла без особого сорта смазок, в состав которых входит все тот же литий. Теперь эти машины свободно совершают рейды в глубь шестого континента даже при температуре минус 60 градусов.
Большую популярность получили многие соединения лития. Способность некоторых из них активно поглощать углекислый газ оказалась особенно ценной для создания нормальных условий в кабинах высотных самолетов и космических кораблей.
Соединение лития с водородом — гидрид лития как источник водорода — заслуживает особого внимания у спасателей. Достаточно смочить его водой, как начнется бурное выделение водорода.
Из 2 килограммов этого вещества получается 5600 литров водорода, т. е. столько же, сколько его может содержать стальной баллон весом 80 килограммов, заполненный под давлением 150 атмосфер. Такая компактная упаковка газа совершенно незаменима для быстрого заполнения спасательных средств, воздушных шаров и надувных лодок.
Хотя литий встречается в природе в ряде очень различных по химическому составу минералов, лишь немногие из них являются экономически жизнеспособными и, следовательно, извлекаемыми.
Пегматиты до сих пор были крупнейшим потенциальным источником лития. Самым качественным месторождением в мире считается месторождение Гринбушес на юго-западе Австралии, где всего 118 млн. тонн руды с содержанием лития 1,4-2,1 % находится в виде остатка (LiAlSi2O6).
Процессы, связанные с получением лития из сырья, очень энергоемки (добыча, дробление больших объемов породы) из-за обращения с крайне щелочными или кислотными химическими веществами и из-за образования значительного количества трудно перерабатываемых отходов.
Другим важным источником добычи полезных ископаемых является рассол, представляющий собой подземные воды с высоким содержанием растворенных веществ. Концентрации лития в них обычно достигают единиц мг/л.
Добыча рапы заключается в истощении подземных вод в поверхностных водоемах и в их самопроизвольном испарении с образованием солей.
Эта технология не требует вспомогательных химикатов и требует меньших затрат энергии, чем т. е, которые необходимы для изоляции лития от силикатных пород. Технология применяется в засушливых районах и в так называемом литиевом треугольнике, в который входят территории Чили, Аргентины и Боливии.
Соль, полученная выпариванием, обычно содержит 1-2% лития, не содержит тяжелых металлов и может быть отправлена непосредственно производителям чистого карбоната лития. В Европе Германия рассматривает возможность получения лития из рассола.
Австралия, Чили, Аргентина, Китай и Зимбабве входят в число крупнейших производителей лития в мире. Первые четыре страны вместе обеспечивают 97% мирового производства лития.
В Европе крупнейшее месторождение лития — Ядар в Сербии, недалеко от города Лозница. Оно было обнаружен в 2004 году и, по оценкам, содержит 125 миллионов тонн лития в форме боросиликата натрия-лития (недавно описанный минеральный нуклит). Массовая доля лития в сырье составляет 1,2–1,8%.
Финансовая привлекательность этого химического элемента как товара, конечно, вызвала интерес к поиску его месторождений по всему миру.
Например, в Чехии найдено месторождение лития Циновец в Крушных горах. Там некоторые рудные граниты содержат 0,05–0,1 % Li, а носителем лития является слюда, называемая цинвальдитом (циннвальдит), которая была описана и названа в 1845 г. по характерному виду из этого местонахождения.
Месторождение Циновец классифицируется геологами как грейзеновые породы, которые представляют собой породы, состоящие в основном из кварца и слюды, подвергшиеся, например, гидротермальному воздействию горячих растворов, богатых фтором и литием.
Циновец имеет запасы примерно 149 500 тонн лития при средней концентрации лития 0,22%. Это не так уж и много по сравнению с аргентинскими запасами, установленными на уровне 17 000 000 тонн.
Однако существенными преимуществами для глубокой добычи являются легкая транспортная доступность участка, близость к перерабатывающим мощностям, возможность развития производства вплоть до конечного продукта (литиевая батарея), а также наличие высококвалифицированных специалистов и дешевой квалифицированной рабочей силы.
По дороге в Салес-де-Жужуй в Аргентне пейзаж похож на открытку из туристического агентства. Кебрада-де-Умауака — одна из главных достопримечательностей Аргентины.
Ожидания, связанные с литием, огромны. Аргентина, страна, нуждающаяся в инвестициях, сразу увидела жилку большого бизнеса. Его природа в изобилии производит «белое золото», а добыча открытым способом дешева. Но одно дело иметь запасы, а другое – экспортный карбонат лития.
Аргентинское законодательство устанавливает, что горнодобывающие ресурсы принадлежат провинциям. Вот почему Жужуй нашел в литии дверь к экономическому росту.
Государство является партнером компании в меньшем процентном соотношении, но оно содействовало параллельным разработкам в области местной индустриализации карбоната лития. Одним из них была поддержка исследовательского центра Conicet, основной организации по продвижению науки в Аргентине.
Солончаки Аргентины являются результатом сотен тысяч лет накопления в низменных районах минералов из испарившейся дождевой воды. Но под поверхностью, в десятках метров, незатронутая солнцем вода образует огромные запасы рассола с концентрациями, в тысячу раз превышающими морскую селитру. Для добычи лития делается бурение, вода добывается и выливается в бассейны, а все остальное делает природа.
На каждую тонну лития расходуется около 600 000 литров рассола и 45 000 литров технической воды.
Цена на литий на мировых рынках неуклонно растет с 2014 года в связи с ожидаемым ростом спроса на электромобили. Однако имеющиеся мощности по добыче на тот момент отставали от потребностей промышленности, что отразилось на пике цен, достигнутом в 2018 году, примерно на уровне 15 евро/кг карбоната лития.
После открытия новых производственных мощностей в Австралии и расширения уже имеющегося производства рынок ожидает стабильного предложения, и сегодня цена составляет около 6 евро (7,25 долларов США)/кг карбоната лития и фиксирует дальнейшее снижение.
Соединения лития
Особый класс неорганических литийсодержащих веществ (кроме тех, которые получены из гидрида лития, LiH), которые были изучены только в недавнем прошлом, представляют собой так называемые интеркаляционные соединения лития.
Типичным представителем является интеркалят LiXC6, образующийся при воздействии паров или расплава лития на графит, восстановлении графита, пропитанного солью лития, или другими способами.
В этом веществе атомы лития внедряются (интеркалируются) между графитовыми слоями. Состав вещества меняется в зависимости от способа приготовления.
В состав интеркаляционных соединений лития могут входить и чисто неорганические вещества LiCoO2, LiMnO2, LiFePO4, в котором ион лития вставлен в пространственный скелет, образованный атомами Со и О соответственно.
Применение лития и его соединений:
- Наибольшая доля произведенного лития используется в производстве аккумуляторов для автомобилей, мобильных телефонов, кардиостимуляторов и компьютеров,
- Литий используется для «закалки» стекла и керамики, смеси, придающей изделию большую термостойкость,
- Токже он используется в металлических сплавах в аэрокосмической и автомобильной промышленности, где необходимы легкие и прочные металлические детали,
- Литий используется в качестве реагента и катализатора в промышленных процессах производства полимеров,
- Ионы лития используется как лекарство для страдающих биполярным расстройством и другими психопатиями, так как снижает окислительный стресс, то есть сглаживает перепады настроения больного,
- Исследования показывают положительные результаты при приеме малых доз лития для эндокринного лечения, например, для контроля функции щитовидной железы.
Литиевые батареи
Литий и его соединения сыграли особую роль в конструкции первичных гальванических элементов на основе Li-SOCl2 и аккумуляторов. Использование лития в батареях выгодно из-за очень низкой молекулярной массы (6,9 г/моль), адекватной реакционной способности и низкой плотности этого элемента.
Благодаря своей низкой молекулярной массе и в то же время низкой плотности литий может обеспечить наибольшее количество электронов на единицу массы среди всех известных металлов. Если любой другой металл в батареях заменить литием, их вес неизбежно увеличится при сохранении емкости.
Для сравнения, литиевая батарея примерно в шесть раз легче свинцово-кислотной батареи той же емкости (то есть имеет в шесть раз большую плотность энергии).
В группе щелочных металлов литий имеет самую низкую реакционную способность. Хотя он медленно выделяет водород при контакте с водой или влагой и может даже воспламеняться, он самовозгорается только в исключительных случаях. Это очень отличается от натрия и калия, которые чаще самовозгораются, или от рубидия или цезия, которые явно самовоспламеняются на воздухе.
Если в конструкции элемента используются интеркалирующие соединения, то применяются технологические преимущества малого ионного радиуса ионов лития. В результате ионы лития очень подвижны, они могут быстро проникать между слоями графита или оксидными электродными структурами и быстро перемещаться по ним.
Такая ячейка затем может быть быстро заряжена, и скорость зарядки не ограничена временем, необходимым для того, чтобы заряженный ион попал на электрод. Каждый владелец мобильного телефона оценит важность этой возможности для пользователя.
Структуры электродов поглощают мелкие частицы, не вызывая серьезных напряжений, что важно, в том числе, для длительного срока службы батареи.
Отсюда следует, что литий — уникальный материал для изготовления аккумуляторов, сочетающий в себе всевозможные полезные свойства.
На практике сегодня используются как первичные литиевые элементы (одноразовые неперезаряжаемые литиевые батареи и батарейки-таблетки), так и вторичные элементы (перезаряжаемые литиевые батареи, например, в мобильных телефонах).
Первичные литиевые элементы
Например, первичный литиевый элемент может быть сконструирован с использованием металлического лития в качестве источника электронов, которые передаются по внешней электрической цепи к электроду, насыщенному тионилхлоридом SOCl2, который захватывает электроны.
Ячейка должна быть хорошо герметизирована от воздействия воды и атмосферы, потому что металлический литий, смешанный с тионилхлоридом, бурно, практически взрывоопасно реагирует со следами влаги.
Литиевая батарея, основанная на этих процессах, была впервые собрана А. Хеллером в 1973 году. Однако она так и не дошла до широкой публики, она предназначалась для использования в военных приложениях и применениях в экстремальных условиях, таких как скандинавская среда, поскольку она надежна даже при -50°С.
Вторичные литиевые элементы
Конструкция вторичных элементов (аккумуляторов) на основе лития демонстрирует большую человеческую сообразительность. Они позволяют буквально запасать энергию, использовать ее при необходимости и восстанавливать запас энергии при ее истощении. Кроме того, весь процесс можно повторять много раз. Акцент делается на безопасном использовании изделия.
Обычный тип литиевых вторичных элементов использует интеркалят LiXC6 вместо металлического лития в качестве источника электронов и интеркалят LiCoO2 в качестве акцептора электронов.
Пространство между электродами заполнено органическим растворителем с растворенной солью лития (например, диметилкарбонатом с хлоридом лития), что обеспечивает электропроводящую среду в ячейке. Этот тип называется литий-ионным аккумулятором.
Интеркалят LiXC6 не реагирует с органическим растворителем, в ячейке не выделяется водород (или какой-либо другой газ). Поэтому отсутствует опасность взрыва при зарядке или разрядке (сравните с зарядкой свинцово-кислотного аккумулятора автомобиля, вырабатывающего водород), элемент химически стабилен.
Электроны выходят из интеркалята лития в графите во внешнюю электрическую цепь. Образовавшиеся ионы лития выходят из органического растворителя в аккумуляторе и проникают в него к катоду элемента.
Электроны подаются на катод ячейки из внешней электрической цепи. Они восстанавливают кобальт, который образует скелет интеркалирующего соединения, из степени окисления III в степень окисления II. Ионы лития, транспортируемые органическим растворителем, входят в интеркалят и компенсируют заряд.
Эти химические процессы обычно используются во всех литиевых аккумуляторах мобильных телефонов, цифровых камер или ноутбуков.
Рост использования литий-ионных аккумуляторов с начала XXI века и появление электромобилей приводят к растущему спросу на литий, который в настоящее время хорошо удовлетворяется. Тем не менее, большее беспокойство, чем литий, по-прежнему является необходимым компонентом практического материала для изготовления катодов.
Азиатские производители были в авангарде поставок литий-ионных аккумуляторов для электромобилей. Основные поставщики CATL, BYD, LG Chem, Samsung и SK Innovation уже увеличили свои производственные мощности и поставили перед собой большие цели на ближайшие годы.
Для производства стандартного аккумулятора электромобиля требуется примерно 10 кг лития и 6 кг кобальта. Даже в последних типах оксидных катодов (например, с составом LiMnXNiYCoZO2) несмотря на усилия исследователей, полностью избежать использования этого дефицитного материала не удается.
Как и в случае с литием, цена на кобальт как на товар резко возросла за последние три года, что было скорректировано, но нехватка кобальта в настоящее время является гораздо большим препятствием для разработки литиевых батарей, чем доступ к литию.
В прошлом кобальт был менее востребованным сырьем, использовавшимся в небольших количествах, добычи которого было достаточно для спроса и потребления. Однако в связи с бурным развитием применения литиевых аккумуляторов ситуация стала меняться.
В 2017–2019 годах можно было говорить даже о кобальтовой лихорадке. Цена на кобальт утроилась.
Кобальт находится в выгодных количествах только в нескольких местах в мире. Основные районы добычи находятся в Демократической Республике Конго (свыше 60% мировой добычи, район Катанги, рудники Катанга и Камото), второстепенные — в Замбии. Кобальт также добывается в Австралии, Канаде и России.
С подорожанием кобальта, кроме крупной промышленной добычи, широкое развитие получила примитивная кустарная добыча. Крайне волатильная цена на кобальт в последние годы стабилизировалась.
Роль лития в современном мире
Литий и его соединения сегодня чрезвычайно важны в технологическом отношении. Их потребление быстро растет. Сейчас они практически незаменимы в самых разных областях человеческой деятельности.
Значение литиевых батарей для хранения энергии, несомненно, будет возрастать с акцентом на возобновляемые источники энергии (солнечные батареи, ветряные электростанции) и электромобильность. Поэтому мы можем утверждать, что эти вещества являются настоящим подарком человечеству на Земле.