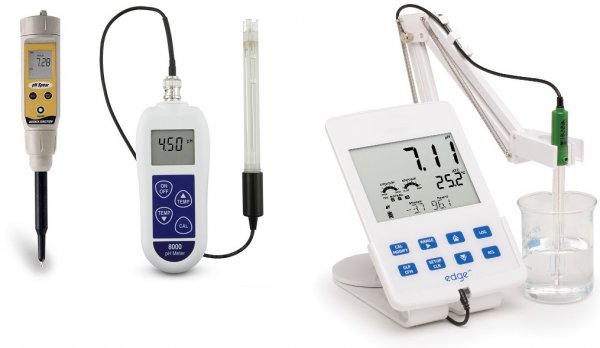
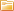Для быстрого определения уровня рН (другими словами - уровня кислотности) различных сред применяют рН-метры. Техническая или питьевая вода, раствор кислоты, соли или щелочи, кровь, моча и другие жидкости организма, фрукты, овощи и прочие продукты питания, медицинские лекарственные средства и так далее — в принципе все что угодно может стать объектом оперативного исследования на значение рН.
Измерение рН — это, по сути, измерение активности ионов водорода в среде. И даже само обозначение рН переводится буквально с латинского «pondus Hydrogenii» как «вес водорода».
На сегодняшний день рН-метры находят широкое применение в микробиологии и в медицине, в водоподготовке и в агрохимии, в почвоведении, в гидропонике, в лабораторных и в полевых исследованиях, в химической и пищевой промышленности, в аквариумистике и много где еще.
Современный рН-метр позволяет достаточно точно и быстро определить величину рН. Если рН равно 7 — среда нейтральная, как например дистиллированная вода, у которой положительных ионов водорода Н+ и отрицательных гидроксид-ионов ОН- поровну. Если кислотность больше 7 — значит среда щелочная. Если же рН меньше 7 — среда кислая.
И хотя химики всегда умели определять кислотность сред классическим методом, используя индикаторы, например фенолфталеин, тем не менее в некоторых процессах просто необходимо точно количественно определить данный показатель, а иногда нужно постоянно отслеживать его с целью корректировки. Для этого и придумали рН-метры.
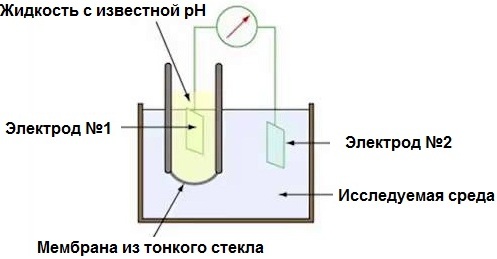
pН-метр фактически является электронным милливольтметром, так как он измеряет разность потенциалов в электрохимической системе из пары электродов и исследуемой среды, в которую они помещены. Правда шкала прибора градуирована здесь не в милливольтах, а в рН, поскольку измеренная ЭДС оказывается пропорциональна рН.
Два электрода: стеклянный индикаторный (боросиликатному стеклу не страшны окислители) и хлорсеребряный — дополнительный электрод сравнения. Стеклянный электрод обладает очень большим сопротивлением в десятки мегаом, и это является как раз основным требованием — чтобы сопротивление зонда не было меньше 0,1 Гом. Градуировку рН-метра делают по буферным растворам с известной рН.
В силу того, что на величину ЭДС влияет температура, каждый такой измерительный прибор имеет термокомпенсацию для измерений при температурах отличных от +25°С. Но для достижения очень высокой точности необходимо проводить измерения точно при температуре +25°С, по этой причине многие рН-метры оснащаются встроенным термометром, чтобы можно было сразу отследить температуру исследуемой среды.
Индикаторный стеклянный электрод в форме трубки с тонкостенным шариком на конце, из особого электропроводящего боросиликатного стекла, включается по сути в электрическую цепь. Перемещение внутри такого стекла положительных ионов Н+ позволяет использовать его (катионы внутри стекла перемещаются относительно полианиона кремниевой кислоты). Внутрь трубки заливается суспензия хлорида серебра в растворе соляной кислоты, затем туда погружается серебряная проволока — так получается хлорсеребряный электрод.
Стеклянный электрод опускают в исследуемую среду, электрическую цепь замыкают, помещая в нее (через электролитический ключ или напрямую) дополнительный электрод сравнения (ртутно-каломелевая паста в растворе хлорида калия). Хлорид калия создает контакт между ртутно-каломелевой частью элемента и исследуемой средой. Этот дополнительный электрод размещается обычно в стеклянном корпусе, для ионов Н+ непроницаемом.
Проводящий контакт раствора хлорида калия в электроде сравнения с исследуемым раствором образуется благодаря тонкой нити или капилляру в стеклянном корпусе. Так получается гальванический элемент из электрода сравнения и хлорсеребрянного электрода, причем электролитическая часть элемента включает в себя проводящую стеклянную пленку и исследуемую среду.
ЭДС электродной системы измеряется милливольтметром, его шкала градуирована в рН. Электроны от хлорсеребряного электрода переносятся к электроду сравнения под действием измеряемой ЭДС, что всегда сопровождается переносом равного количества протонов с внутренней стороны стеклянного электрода в среду.
Если в этом случае принять концентрацию положительных ионов водорода Н+ внутри стеклянного электрода постоянной, то ЭДС получится функцией активности Н+, то есть функцией рН исследуемой среды.
Есть рН-метры карманные бытовые, есть профессиональные лабораторные, портативные и промышленные стационарные. Некоторые рН-метры измеряют концентрацию ионов в среде, содержание нитратов и т. д., обладают встроенной памятью для сохранения результатов, возможностью связи с компьютером и функцией коррекции параметров по цепи обратной связи.